Presión de Vapor Saturado
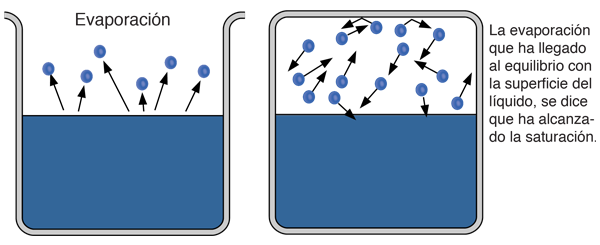
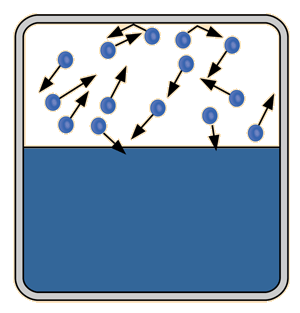
Si en un contenedor cerrado tiene lugar el proceso de la evaporación, llegará un momento en que haya tantas moléculas regresando al estado líquido, como las que escapan al estado de gas. En este punto, se dice que el vapor está saturado, y la presión de ese vapor (normalmente expresado en mmHg), se llama presión de vapor saturado.
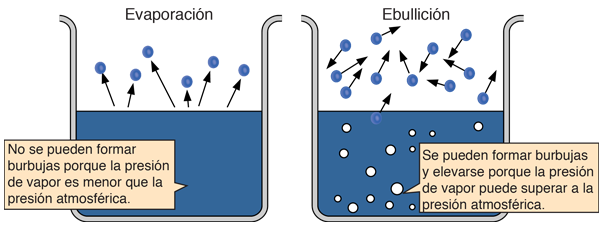
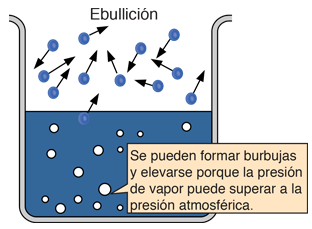
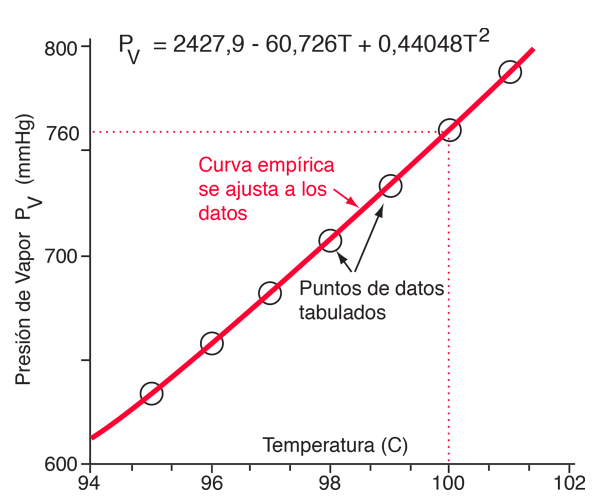
| Puesto que la energía cinética molecular es mayor a mas alta temperatura, mas moléculas pueden escapar de la superficie y consiguientemente la presion de vapor saturado es mas alta. Si el líquido está abierto al aire, entonces la presión de vapor se estima como una presión parcial, junto con los otros constituyentes del aire. La temperatura a la cual la presión de vapor es igual a la presión atmosférica, se le llama temperatura del punto de ebullición. |
 |
| Tabla para el Agua | Gráfica para el Agua |
Conceptos sobre Teoría Cinética
Aplicaciones sobre Teoría Cinética
Conceptos de Aplicación de Vapor
| HyperPhysics*****Termodinámica | M Olmo R Nave |