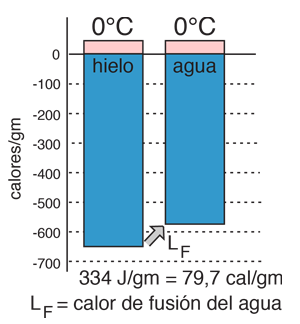
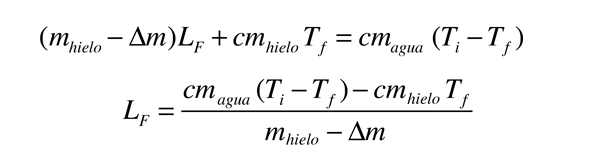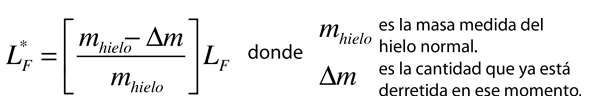Calor de Vaporización
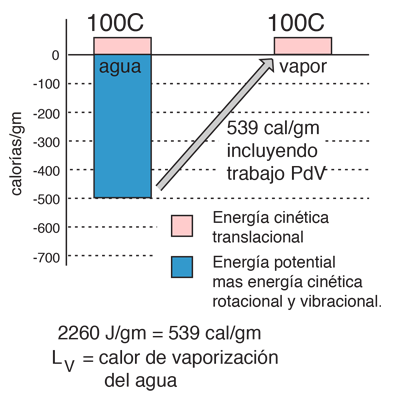
| Se llama "calor de vaporización", la energía necesaria para cambiar 1 gramo de sustancia en estado líquida, al estado gaseoso en el punto de ebullición. Esta energía rompe las fuerzas atractivas intermoleculares y también debe proveer la energía necesaria para expandir el gas (el trabajo PDV ). En un gas ideal, ya no hay ninguna energía potencial asociada con las fuerzas intermoleculares. De modo que la energía interna, está completamente en forma de energía cinética molecular.
La energía final representada aquí como energía cinética de traslación, no es estrictamente cierta. También hay un poco de energía de vibración y de rotación.
|
Una característica importante del cambio de fase de vaporización del agua, es el gran cambio en el volumen que lo acompaña. Una mol de agua son 18 gramos, y a la TPE si esa mol la evaporamos a gas, ocupará 22,4 litros. Si el cambio es de agua a vapor a 100°C, en vez de 0°C, entonces por la ley de gas ideal ese volumen se incrementa en la proporción de las temperaturas absolutas, 373K/273K, o sea a 30,6 litros. Comparando esto con el volumen de agua líquida, ha habido un factor de expansión de 30600/18 = 1700, cuando está evaporada a 100°C. Este es un hecho físico que conocen los bomberos, porque ese aumento de 1.700 veces el volumen, cuando en un incendio se rocía el agua sobre una superficie caliente, puede ser explosiva y peligrosa.
Una forma de visualizarlo, es teniendo en cuenta el volumen que ocupa en una probeta graduada 18 ml. de agua en estado líquido, y que corresponden a un número de moléculas igua al número de Avogadro. Si se convirtieran a vapor a 100°C esta misma mol de moléculas de agua, llenaría un globo de 38,8 cm. de diámetro (15,3 pulgadas).
|
Índice
Conceptos sobre Cambio de Fase |