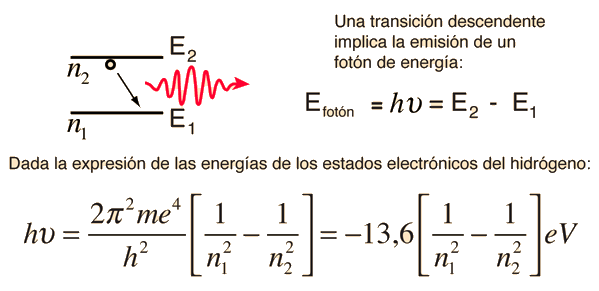
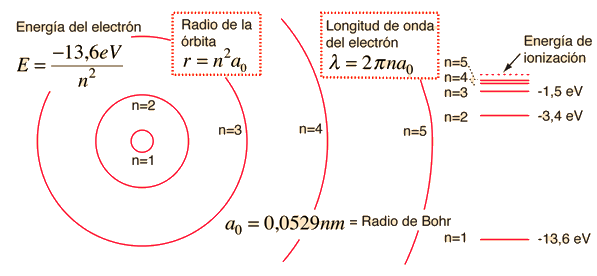
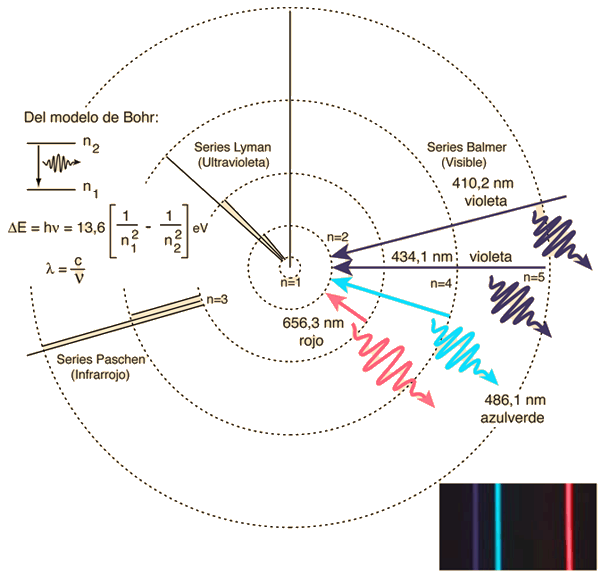
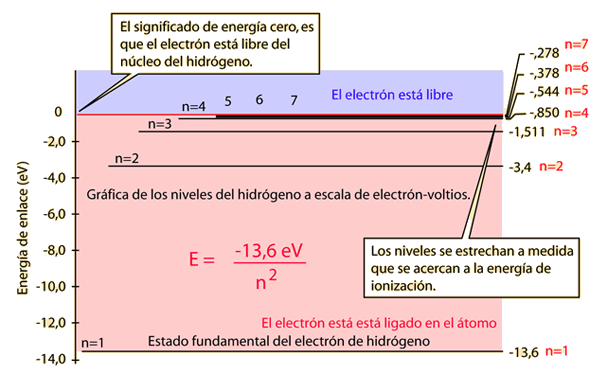
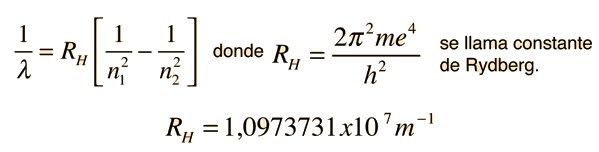Gráfica de Niveles de Energías del Hidrógeno
La estructura básica de los niveles de energía del hidrógeno, puede ser calculada a partir de la ecuación de Schrodinger. Los niveles de energía de acuerdo con el anterior modelo de Bohr, y de acuerdo con la experiencia, difieren en una fracción pequeña de un electrón voltios.
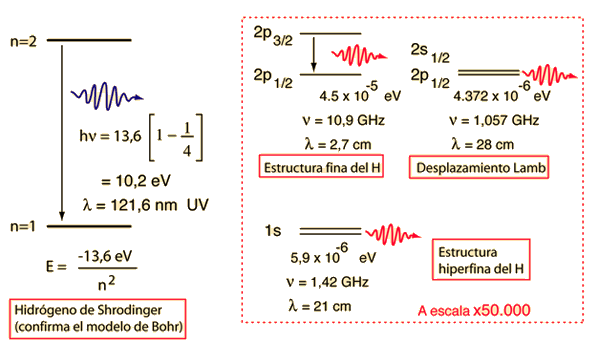
Si se mira a los niveles de energía del hidrógeno con una resolución extremadamente alta, se encuentra evidencia de algunos otros efectos pequeños en la energía. El nivel 2p está dividido en un par de líneas por el efecto spin-órbita. Los estados 2s y 2p se encuentran que difieren en una pequeña cantidad, en lo que se llama el desplazamiento de Lamb. E incluso el estado fundamental 1s está dividido por la interacción del espín del electrón y el espín nuclear, en lo que se llama estructura hiperfina.
|
Índice
Conceptos del Hidrógeno
Conceptos de Estructura Atómica |