Enegía Libre de Helmholtz
En la termodinámica química de las reacciones y en los procesos no cíclicos, existen cuatro cantidades útiles llamadas "potenciales termodinámicos". Estos son la energía interna, la entalpía, la energía libre de Helmholtz y la energía libre de Gibbs. La energía libre de Helmholtz se define por

La energía interna U, podría ser considerada como la energía necesaria para crear el sistema, en ausencia de cambios en la temperatura o el volumen. Pero si el sistema se crea en un ambiente de temperatura T, entonces parte de la energía se puede obtener mediante la transferencia espontánea de calor desde el medio ambiente al sistema. La cantidad de transferencia de energía espontánea es TS, donde S es la entropía final del sistema. En ese caso ya no hay que poner mas energía. Note que si se crea un estado final mas desordenado (mayor entropía), se requiere menos trabajo para crearlo. Así pues, la energía libre de Helmholtz es una medida de la cantidad de energía que tenemos que poner para crear un sistema, una vez que ya se ha efectuado la transferencia espontánea de energía del medio ambiente.
|
Los cuatro potenciales termodinámicos están relacionados entre sí, por medio de las compensaciones que representan los términos de la "energía del ambiente" TS y el "trabajo de expansión" PV. Un diagrama mnemotécnico propuesto por Schroeder, le puede ayudar a no perder de vista las relaciones entre los cuatro potenciales termodinámicos. |
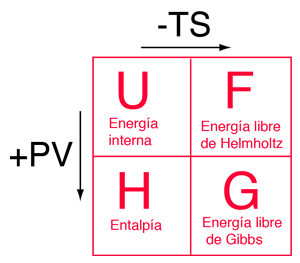 |
Conceptos sobre Energía Interna
Referencia
Schroeder
Cap. 5
| HyperPhysics*****Termodinámica | M Olmo R Nave |
