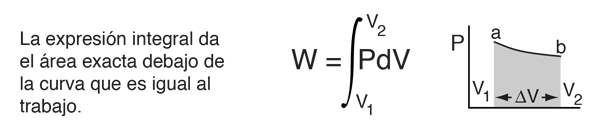Primera Ley de la Termodinámica
La primera ley de la termodinámica, es la aplicación del principio de conservación de la energía, a los procesos de calor y termodinámico:

La primera ley hace uso de los conceptos claves de energía interna, calor, y trabajo sobre un sistema. Usa extensamente el estudio de los motores térmicos. La unidad estándar de todas estas cantidades es el julio, aunque algunas veces se expresan en calorías o BTU.
En los textos de Química es típico escribir la primera ley como ΔU=Q+W. Por supuesto que es la misma ley, -la expresión termodinámica del principio de conservación de la energía-. Exactamente se define W, como el trabajo realizado sobre el sistema, en vez de trabajo realizado por el sistema. En un contexto físico, el escenario común es el de añadir calor a un volumen de gas, y usar la expansión de ese gas para realizar trabajo, como en el caso del empuje de un pistón, en un motor de combustión interna. En el contexto de procesos y reacciones químicas, suelen ser mas comunes, encontrarse con situaciones donde el trabajo se realiza sobre el sistema, mas que el realizado por el sistema.
| Energía Interna en la Identidad Termodinámica |
Conceptos sobre Motores Térmicos
| HyperPhysics*****Termodinámica | M Olmo R Nave |