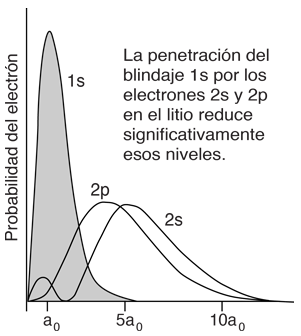
¿Qué Causa que las Energías del Electrón Dependan del Número Cuántico Orbital?
Por el modelo de Bohr ó por la ecuación de Schrodinger, del hidrógeno, la solución de los niveles de energía del electrón da:
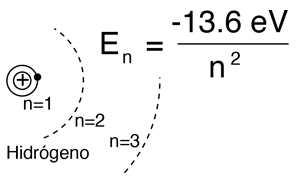 |
Esto concuerda con el espectro del hidrógeno, a menos que se eche un vistazo de alta resolución a la estructura fina, o la estructura producida por campos magnéticos externos, (efecto Zeeman), etc. |
Los átomos parecidos al hidrógeno tales como el litio y el sodio, podría esperarse que mostraran niveles similares de energía. Se componen de capas completas con un solo electrón exterior. Visionando una estructura de capas tipo Bohr, con un solo electrón en la capa externa, la carga neta dentro de esa capa es, justo una carga neta positiva. Esto conduce a la expectativa siguiente:
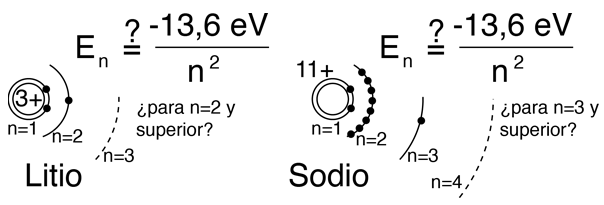
Sin embargo, cuando se utilizan datos de los espectros para construir los diagramas de niveles de energía de estos átomos, se encuentra una fuerte dependencia de la energía orbital en los electrones de momento angular bajo, como se muestra a continuación.
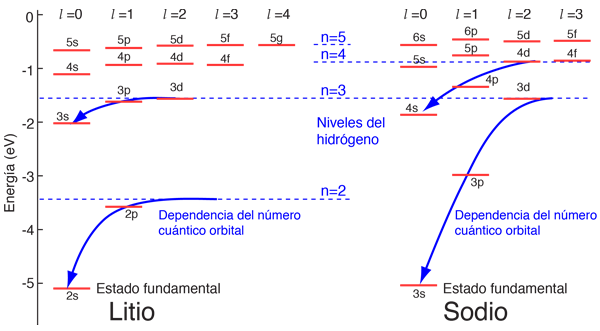
¿Cual es el Origen de la Dependencia del Número Cuántico Orbital?
Conceptos de la Ecuación de Schrödinger
Conceptos del Hidrógeno
| HyperPhysics*****Física Cuántica | M Olmo R Nave |