La Entropía como Flecha del Tiempo
Una de las ideas involucradas en el concepto de entropía es que, en los sistemas aislados la naturaleza tiende del orden al desorden. Esto nos dice que la caja de moléculas de la derecha, ocurrió antes que la de la izquierda.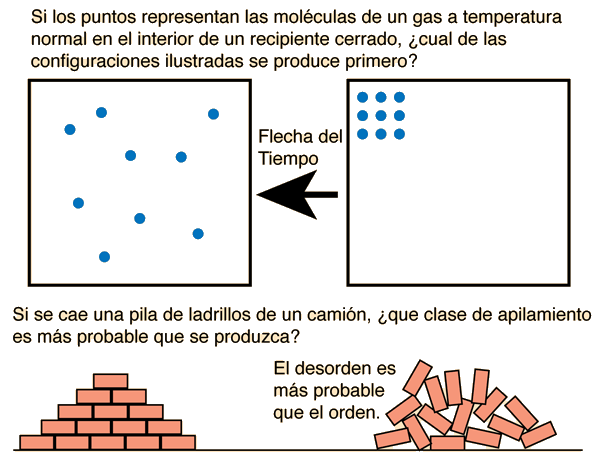
Si hubiésemos usado las leyes de Newton para describir el movimiento de las moléculas, no nos daría la información de que fué lo primero que ocurrió.
Advertencias y Objeciones
Existen algunas sutilezas en la naturaleza de la entropía y otras cantidades termodinámicas, sutilezas que intentamos poner en imágenes de palabras y bocetos que a veces simplifican demasiado. En la enseñanza de la termodinámica, siempre he tratado de tener en mente las palabras de uno de los grandes maestros de física de mediados del siglo XX, Mark Zemansky:
es tan fácil como una canción:
Crees que lo haces más simple
cuando lo haces un poco peor."
Los diagramas anteriores han generado una discusión animada, en parte debido al uso del orden versus desorden en la introducción conceptual de la entropía. Es típico que los físicos utilicen este tipo de introducción porque introduce rápidamente el concepto de multiplicidad de una manera visual y física, con analogías en nuestra experiencia común. Los químicos, por otro lado, a menudo protestan contra este enfoque porque en las aplicaciones químicas el concepto orden-desorden no comunica las ideas necesarias a nivel molecular y, de hecho, puede ser engañoso. El hecho mismo de las diferencias de opinión sobre el uso del orden y el desorden puede en sí mismo ser instructivo.
El diagrama superior muestra la flecha del tiempo apuntando desde el orden al desorden, pero uno debe admitir que la tendencia aparente de pasar del orden al desorden no es la forma más fundamental de mirar el diagrama superior. A temperaturas ordinarias, la energía interna de un gas le daría a las moléculas altas velocidades, y es evidente que esta disposición ordenada sería muy rara porque hay solo unas pocas formas de hacerlo. Si ocurriera, sería por un breve instante y luego las moléculas se moverían a alguna otra configuración. El diagrama de la izquierda muestra una configuración más aleatoria o desordenada, pero el punto clave es que hay una gran cantidad de formas en que se podrían lograr tales configuraciones. Así que la multiplicidad es el concepto clave: los conjuntos moleculares tenderán espontáneamente a evolucionar desde configuraciones de menor multiplicidad a configuraciones de mayor multiplicidad.
El diagrama inferior es de nuevo una imagen con la que la experiencia común se identifica de inmediato: hay más formas de crear una pila de ladrillos mezclada que una disposición cuidadosamente apilada. Una vez más, la idea de multiplicidad es el punto clave. Las objeciones a este tipo de introducción a la entropía provienen del hecho de que las aplicaciones útiles de la entropía son termodinámicas e involucran a la naturaleza a escala atómica y molecular. Los ladrillos ordenados frente a la pila mezclada pueden ser una visualización introductoria útil, pero si estas dos pilas de ladrillos estuvieran a la misma temperatura, entonces el valor numérico de la entropía sería casi idéntico para las dos pilas. Si las contribuciones a la entropía implican la multiplicidad de formas en que se puede organizar el gran número de moléculas en las dos pilas de ladrillos, entonces el hecho de que las orientaciones macroscópicas de los ladrillos sean diferentes es una contribución insignificante a la entropía total. La entropía es un concepto microscópico crucial para describir la termodinámica de los sistemas de moléculas, y la asignación de entropía a objetos macroscópicos como ladrillos no tiene ningún valor práctico aparente, excepto como una visualización introductoria.
Conceptos sobre Entropía
| HyperPhysics*****Termodinámica | M Olmo R Nave |
