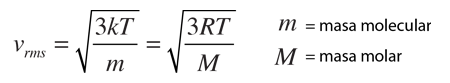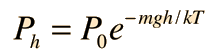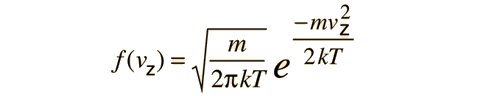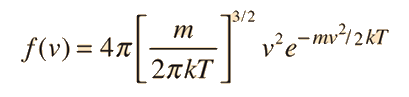Temperatura Cinética
La expresión para la presión de gas desarrollada desde la teoría cinética, relaciona la presión y el volumen del gas con la energía cinética molecular media. La comparación con la ley de gas ideal nos conduce a una temperatura llamada algunas veces temperatura cinética.

Esto nos conduce a la expresión
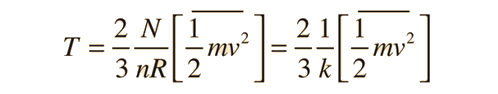
La forma mas familiar expresa la energía cinética molecular media:
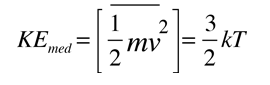 |
|
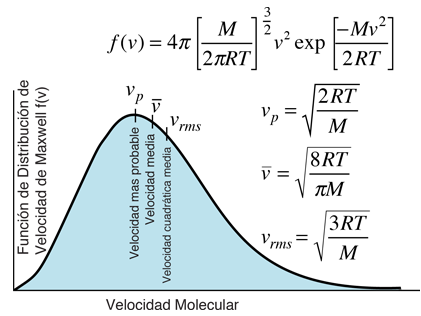
Es importante señalar que la energía cinética media que se utiliza aquí, se limita a la energía cinética de traslación de las moléculas. Es decir, son tratadas como masas puntuales y no se tiene en cuenta los grados de libertad internos, tales como la rotación molecular y la vibración. Esta distinción es muy importante cuando se tratan temas como los calores específicos de gases. Al tratar de evaluar el calor específico, se debe tener en cuenta toda la energía que poseen las moléculas, y la temperatura tal como ordinariamente se mide no tiene en cuenta la rotación y vibración molecular. La temperatura cinética es la variable necesaria para temas como la transferencia de calor, ya que es la energía cinética de traslación, que conduce la transferencia de energía, desde zonas calientes (mayor temperatura cinética, mayores velocidades moleculares), a zonas frías (menores velocidades moleculares), en una transferencia colisional directa.
| Constantes Definidas | Equipartición de Energía | Energía Térmica |
Conceptos de Gas Ideal
Conceptos sobre Teoría Cinética
| HyperPhysics*****Calor y Termodinámica | M Olmo R Nave |