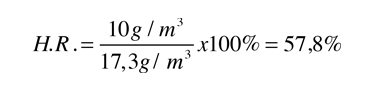¿Cuanta Humedad puede "Mantener" el Aire?
| ¡Atención! Existen peligros y posibles malentendidos sobre estas definiciones comunes de la humedad relativa. |
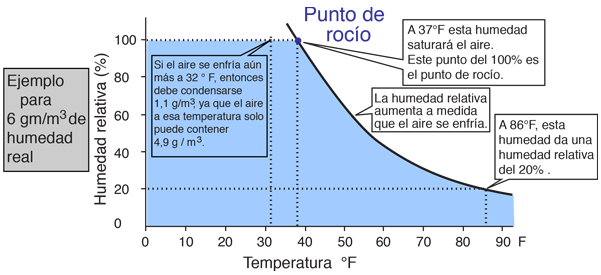
| La humedad relativa es la cantidad de humedad en el aire comparada con la que el aire puede "mantener" a esa temperatura. Cuando el aire no puede "mantener" toda la humedad, entonces se condensa como rocío. |
|
De todas las declaraciones sobre la humedad relativa que he oído en las conversaciones cotidianas, la anterior es probablemente la más común. Puede representar una comprensión del fenómeno, y tiene alguna utilidad de sentido común, pero puede representar un desconocimiento total de lo que está pasando físicamente. El aire no "mantiene" el vapor de agua, en el sentido de tener una fuerza atractiva o alguna influencia en su captura. Las moléculas de agua son en realidad más ligeras y con velocidades mayores que las moléculas del nitrógeno y del oxígeno que componen la mayor parte del aire, y ciertamente no se adhieren a estas ni están mantenidas por estas en ningún sentido. Si examinamos la energía térmica de las moléculas del aire a la temperatura ambiente de 20°C, encontraremos que la velocidad media de las moléculas de agua en el aire es de 600 m/s o unas ¡1400 millas/hr!. ¡No vamos a "sotener" esa molécula!.
Otro punto de vista posiblemente útil, sería considerar el espacio entre las moléculas de aire en condiciones atmosféricas normales. A partir del conocimiento de las masas atómicas y densidades del gas y la modelización de la trayectoria libre media de las moléculas de gas, se puede concluir que la separación entre las moléculas de aire a presión atmosférica y 20°C., es unas 10 veces su diámetro. Esto supone que pueden viajar entre colisiones, una distancia del orden de 30 veces su separación. Por lo tanto las moléculas de agua en el aire tienen un montón de espacio para moverse y no son "retenidas" por las moléculas de aire.
Cuando se dice que el aire puede "mantener" una cierta cantidad de vapor de agua, el hecho que se está tratando es que, una cierta cantidad de vapor de agua puede estar residiendo en el aire como un componente del aire. Las moléculas de agua de alta velocidad actuan en gran medida como partículas de un gas ideal. A una presión atmosférica de 760 mm Hg, la cantidad de agua en el aire se puede expresar en términos de la presión parcial en mm Hg, la cual representa la contribución a la presión de vapor de las moléculas de agua. Por ejemplo, a 20°C, la presión de vapor de saturación del vapor de agua es de 17,54 mm Hg, de modo que si el aire se satura con el vapor de agua, los principales constituyentes atmosféricos, nitrógeno y oxígeno, están colaborando en la mayor parte de los 742 mm Hg de presión atmosférica restante.
Pero el vapor de agua es un tipo de componente del aire, muy diferente del oxígeno y el nitrógeno. El oxígeno y el nitrógeno a temperaturas terrestres, son siempre gases, con puntos de ebullición de 90ºK y 77ºK, respectivamente. Practicamente siempre actuan como gases ideales. Pero extraordinariamente en la Tierra, el agua que tiene un punto de ebullición de 100ºC= 373,15ºK, puede existir en las fases sólida, líquida y gaseosa. Se trata esencialmente, de un proceso continuo de intercambio dinámico de moléculas entre estas fases. En el aire a 20ºC, si la presión de vapor alcanza 17,54 mm Hg, entonces las moléculas de agua del proceso continuo citado, que entren a la fase líquida, igualarán a las que escapan a la fase gaseosa, de modo que decimos que el vapor está "saturado". Aunque a menudo el uso común lo sugiere, no tiene nada que ver con que el aire "sostenga" a las moléculas de agua. Cuando el aire alcanza la saturación, decimos que estamos alcanzado el "punto de rocío". Las moléculas de agua son polares y presentan cierta fuerza de atracción neta entre ellas, por tanto se apartan del comportamiento de un gas ideal.
En la atmósfera, mediante la recopilación de moléculas y su entrada al estado líquido, pueden formarse gotas de agua que conforman las nubes, o cerca de la superficie para formar la niebla, o en la propia superficie para formar el rocío.
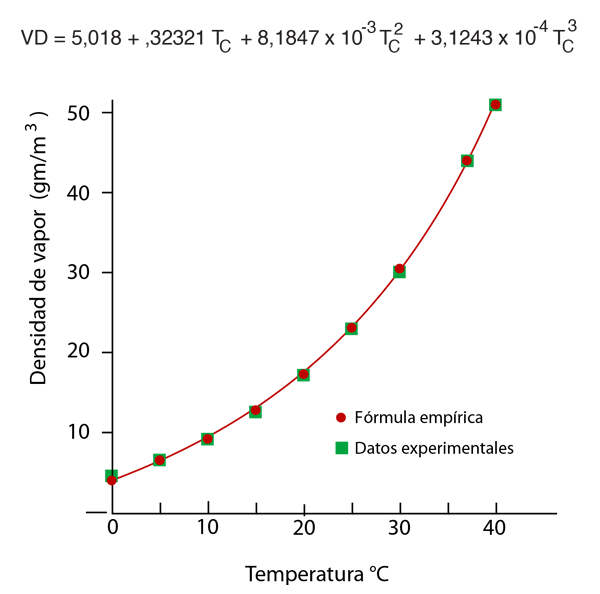
Otro método que podría ayudar a aclarar el punto de que el aire en realidad no "mantiene" el agua, es tener en cuenta que la humedad relativa no tiene nada que ver con las moléculas de aire (es decir, N2 y O2). Si tenemos un frasco cerrado a 20ºC con agua líquida en su interior y sin ningún aire, alcanzará el equilibrio a la presión de vapor saturado de 17,54 mm Hg. En ese momento tendría una densidad de vapor de 17,3 gm/m3 de vapor de agua pura en la fase gaseosa, por encima de la superficie del agua líquida. Pero si solo hubiéramos quitado el aire y sellado el contenedor con el agua líquida en su interior, podríamos tener una situación, donde hubiera solamente 8,65 gm/m3 de agua en estado gaseoso en un momento particular. Diríamos que la humedad relativa en el frasco en ese momento es del 50%, porque la densidad de vapor de agua residente es la mitad de su densidad de saturación. Sería exactamente igual que lo que diríamos en una situación con el aire presente - 8,65 gm/m3 de vapor de agua en el aire a 20ºC representa 50% de humedad relativa-. Bajos estas condiciones, las moléculas de agua estarían evaporándose de la superficie hacia la fase gaseosa mas rapidamente que las que estarian entrando en la superficie del agua, de modo que la presión de vapor del vapor de agua por encima de la superficie, estaría elevándose hasta la presión de vapor de saturación.
|
Índice
Conceptos sobre Teoría Cinética
Aplicaciones sobre Teoría Cinética
Conceptos sobre Aplicación de Vapor |