Cloruro Sódico
|
El cloruro sódico es la sal mas común, la sal de mesa común utilizada para condimentar los alimentos. Se forma en cristales cúbicos evidente incluso en la sal de mesa. Se presenta comúnmente en forma mineral, la halita, también llamada sal de roca. Se puede formar por la reacción ácido-base del ácido clorhídrico e hidróxido de sodio: |
 |
Como sólido, el cloruro de sodio es cristalino y forma una red cúbica. La unión de los átomos de sodio y cloro es uno de los ejemplos clásicos de enlace iónico. En solución acuosa ioniza los iones Na+ y Cl-, y forma una solución eléctricamente conductora.  Sal de mesa ordinaria, 50x |
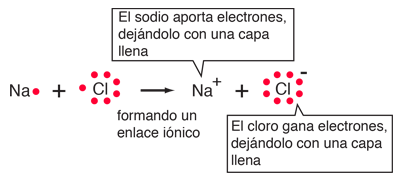 | El enlace iónico del NaCl se puede visualizar en términos de diagramas de Lewis. |
Cuando se miden los diámetros del sodio y del cloro y sus iones, ofrecen una confirmación de la imagen del enlace iónico
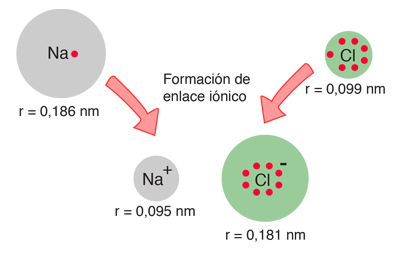 | Cuando el sodio pierde un electrón para formar Na+, su tamaño efectivo se reduce a la mitad. Cuando el cloro gana un electrón para producir la estructura de octeto Cl-, su tamaño aumenta a casi el doble (Shipman, et al). |
El cloruro de sodio existe en la Tierra en gran abundancia en el agua del mar, y es una parte importante de los electrolitos líquidos de los seres humanos y otros organismos vivos.
| Detalles del Enlace |
| Ejemplo de Energía de Enlace |
| Sales Comunes |
| Compuestos Inorgánicos |
Conceptos de Química
Referencia
Shipman, Wilson and Todd
Cap. 12
| HyperPhysics*****Química | M Olmo R Nave |