Energias de Ionización
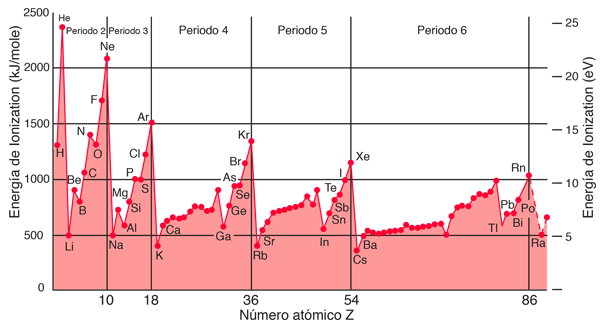
La energía de ionización o potencial de ionización, es la energía necesaria para extraer un electrón de un átomo neutro. Es mínima para los metales alcalinos que tienen un solo electrón fuera de una capa completa. Por lo general, aumenta en cada fila de la tabla periódica, con el máximo en los gases nobles que tienen capas completas. Por ejemplo, el sodio requiere sólo 496 kJ/mol o 5,14 eV/átomo para ionizarlo, mientras que el neón, el gas noble que le precede inmediatamente en la tabla periódica, requiere 2081 kJ/mol o 21,56 eV/átomo. La energía de ionización es una de las consideraciones de la energía primarias utilizadas en la cuantificación de los enlaces químicos.
La energía de ionización para cualquier elemento, se puede encontrar haciendo clic en su símbolo químico de la tabla periódica.
Conceptos de Enlace Químico
Referencia
Ebbing
| HyperPhysics*****Química | M Olmo R Nave |