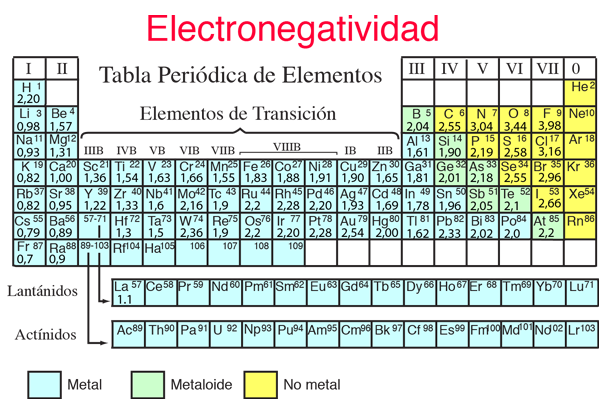
Energía de Ionización y Afinidad Electrónica
La energía de ionización o potencial de ionización, es la energía necesaria para extraer un electrón de un átomo neutro. Es mínima para los metales alcalinos que tienen un solo electrón fuera de una capa completa. Por lo general, aumenta en cada fila de la tabla periódica, con el máximo en los gases nobles que tienen capas completas. Por ejemplo, el sodio requiere sólo 496 kJ/mol o 5,14 eV/átomo para ionizarlo, mientras que el neón, el gas noble que le precede inmediatamente en la tabla periódica, requiere 2081 kJ/mol o 21,56 eV/átomo. La energía de ionización puede ser considerada como un tipo de propiedad en contra de la electronegatividad en el sentido de que una baja energía de ionización implica que un elemento da fácilmente electrones a una reacción, mientras que una alta electronegatividad implica que un elemento busca fuertemente tomar electrones en una reacción.
La afinidad electrónica es una medida de la variación de energía cuando se añade un electrón a un átomo neutro para formar un ion negativo. Por ejemplo, cuando un átomo de cloro neutro en forma gaseosa recoge un electrón para formar un ion Cl-, libera una energía de 349 kJ/mol o 3,6 eV/átomo. Se dice que tienen una afinidad electrónica de -349 kJ/mol, y este número cuando es grande, indica que se forma un ion negativo estable. Números pequeños indican que se forma un ion negativo menos estable. Los grupos VIA y VIIA de la tabla periódica tienen las mayores afinidades electrónicas.
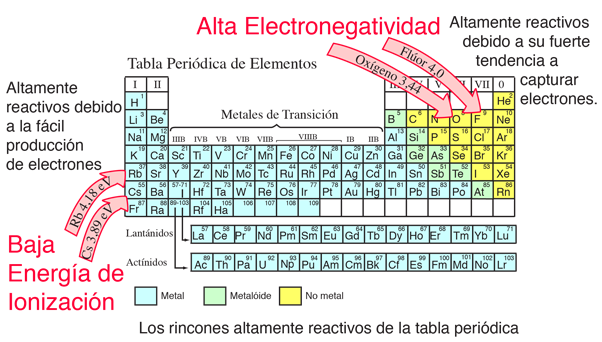
| Gráfica de Energia de Ionización de los Elementos |
| Tabla de Afinidades Electrónicas |
Conceptos de Enlace
| HyperPhysics*****Química | M Olmo R Nave |