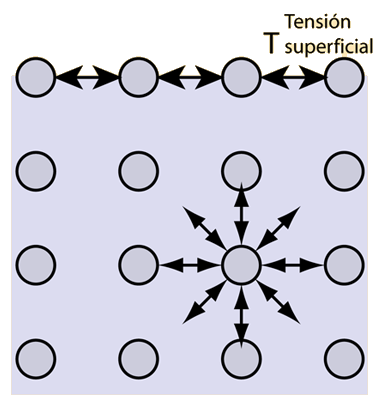
Tensión Superficial
Las fuerzas cohesivas entre las moléculas de un líquido, son las responsables del fenómeno conocido como tensión superficial. Las moléculas de la superficie no tienen otras iguales sobre todos sus lados, y por lo tanto se cohesionan mas fuertemente, con aquellas asociadas directamente en la superficie. Esto forma una película de superficie, que hace mas dificil mover un objeto a traves de la superficie, que cuando está completamente sumergido.
La tensión superficial, se mide normalmente en dinas/cm., la fuerza que se requiere (en dinas) para romper una película de 1 cm. de longitud. Se puede establecer de forma equivalente la energía superficial en ergios por centímetro cuadrado. El agua a 20°C tiene una tensión superficial de 72.8 dinas/cm comparada con 22.3 para el alcohol etílico y 465 para el mercurio.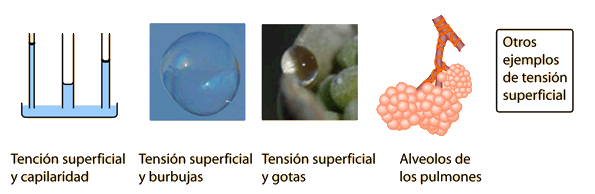
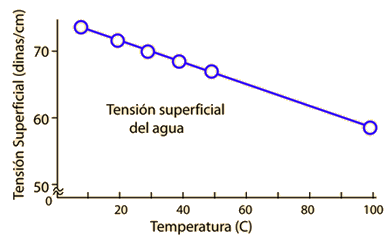
| Disminución de la Tension Superficial del Agua con el Calor |
Conceptos de Fluidos
| HyperPhysics*****Mecánica*****Fluidos | M Olmo R Nave |