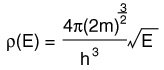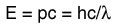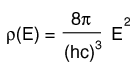La Distribución de Energía
La distribución de una cantidad fija de energía entre un número de partículas idénticas, depende de la densidad de estados de energía disponibles, y la probabilidad de que sea ocupado un estado dado. La probabilidad de que sea ocupado un estado de energía determinado, está dada por la función de distribución, pero si existen más estados de energía disponibles en un intervalo de energía dado, entonces, esto le dará un mayor peso a la probabilidad para ese intervalo de energía.

| Función de Distribución | Densidad de Estados |
Conceptos de Estadística Aplicada
| HyperPhysics*****Física Cuántica | M Olmo R Nave |