Repulsión de Pauli en Moléculas Iónicas
Un enlace iónico puede ser modelado en términos de la energía de ionización para producir el ión positivo, la afinidad electrónica asociada con el ión negativo, la energía de disociación de la molécula, el potencial de Coulomb entre los iones, y la fuerza de repulsión que limita la proximidad de acercamiento de los iones. Esta fuerza de repulsión se suele llamar repulsión de Pauli. El balance de energía de todos estos términos se puede escribir en la forma

Los datos medidos sobre las moléculas diatómicas iónicas nos permiten obtener la energía de la fuerza de repulsión de Pauli en la separación de equilibrio. Está modelado arriba con dos parámetros, C, y uno que puede ser ajustado para calcular los datos. Esta fuerza de repulsión es más que una repulsión electrostática entre las nubes de electrones de los dos átomos. Tiene un carácter mecánico cuántico basado en el principio de exclusión de Pauli, llamado a menudo simplemente "repulsión por el principio de exclusión". Cuando los iones están muy separados, las funciones de onda de sus principales electrones no se superponen de manera significativa, y pueden tener idénticos números cuánticos. A medida que se acerca, la creciente superposición de las funciones de onda hace que algunos se vean obligados a estados de energía más altos. No hay dos electrones que puedan ocupar el mismo estado, de manera que el nuevo conjunto de estados de energía está formado por un sistema de dos núcleos, los estados de menor energía se llenan y algunos de los electrones son empujados a estados superiores. Esto requiere energía y es experimentado como una repulsión, impidiendo que los iones se acerquen mas el uno al otro. La naturaleza del término de la repulsión de Pauli para el cloruro de sodio se muestra a continuación en el diagrama de energía.
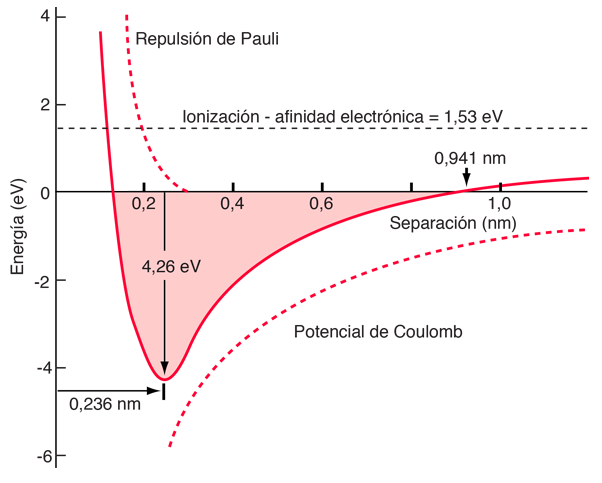
Como las energías de ionización, las afinidades electrónicas, y las energías de disociación se han tabulado por los experimentos, y puesto que la longitud del enlace es obtenible a partir de experimentos independientes, tales como la espectroscopia de rotación, es posible estimar la energía de la repulsión de Pauli mediante el uso de la fórmula anterior. A continuación se muestran algunos ejemplos, con el término de Pauli calculado a partir de los otros datos, como el valor que equilibraría la energía.
| Molécula | Ion positivo | Ion negativo | (Longitud de enlace) | en el equilibrio | para el balance de energía | |||||||
Para los haluros alcalinos, el término de Pauli es unas pocas décimas de un eV. Los valores del término de Pauli para los hidruros es bastante diferente, sugiriendo que está pasando algo diferente, pero me falta el conocimiento químico para hacer más comentarios al respecto. Cualquier comentario será bienvenido.
| Enlaces Químicos |
Referencia
Rohlf
Sec 10.2
| HyperPhysics*****Física Cuántica*****Química | M Olmo R Nave |