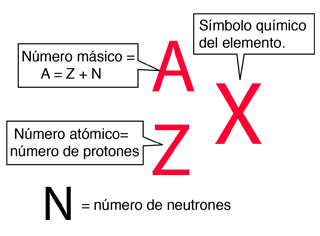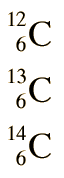Isótopos
Los diferentes isótopos de un elemento dado tienen el mismo número atómico pero diferentes números de masa, ya que tienen diferentes números de neutrones. Las propiedades químicas de los diferentes isótopos de un elemento son idénticas, pero a menudo tienen grandes diferencias en su estabilidad nuclear. En los isótopos estables de los elementos ligeros, el número de neutrones es casi igual al número de protones, pero un creciente exceso de neutrones es característico de elementos pesados estables. El elemento estaño (Sn), tiene los isótopos más estables con 10. El promedio es de aproximadamente 2,6 isótopos estables por elemento.

Se puede encontrar información sobre los isótopos de cada elemento y su abundancia, yendo a la tabla periódica y eligiendo un elemento. Luego, se puede tomar el enlace a los datos nucleares.
Los Isótopos son (casi) Químicamente Idénticos
Es significativo apreciar que los tres isótopos del hidrógeno cambian en la masa por un factor de tres, pero sus propiedades químicas son prácticamente idénticas. Una pequeña diferencia en las frecuencias espectrales del hidrógeno y del deuterio, proviene de una fuente esencialmente mecánica, el ligero cambio en la "masa reducida" asociada con el electrón en órbita. Pero para fines prácticos, el comportamiento químico de los isótopos de cualquier elemento son idénticos.
El contribuidor dominante a las interacciones entre los átomos y su entorno es la fuerza electromagnética. No debería ser sorprendente que un neutrón extra o dos en un núcleo, no tiene casi ningún efecto en la interacción con el mundo. El examen de un modelo a escala del átomo, pone en evidencia que el núcleo es muy pequeño en comparación con el tamaño del átomo. El radio nuclear del carbono-12 es 2,7 x 10-15 m, mientras que el tamaño del átomo por la tabla periódica es sobre 0,9 x 10-10 m, unas 33.000 veces mas grande!
|
Índice |