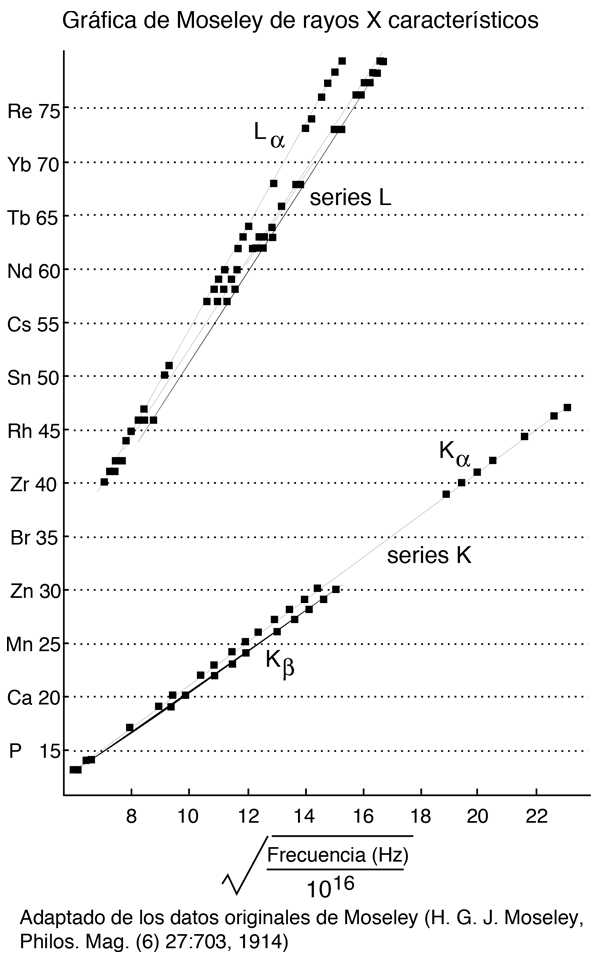
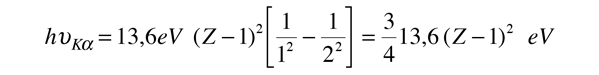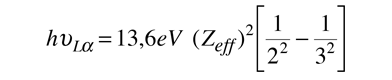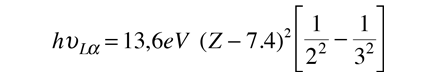Modelación de las Frecuencias de Rayos X de Moseley
La fórmula empírica de Moseley para los rayos X K-alfa, tras su adaptación al modelo de Bohr se convierte en
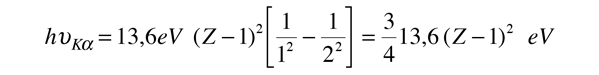
La implicación de esta fórmula es, que el simple electrón en la capa K antes de la emisión, es casi el 100% de efectivo en el blindaje del núcleo, de modo que el electrón de la capa L ve una carga nuclear efectiva de Z-1. Se puede usar esta fórmula para calcular las energías cuánticas aproximadas, y las longitudes de onda de los rayos-X K-alfa.
Por ejemplo, este cálculo para Z = 42 da una longitud de onda de 0,0722 nm para los rayos X K-alfa del molibdeno, mientras que el valor medido es 0,0707 nm. Así que el acuerdo es razonable para estos rayos X, aunque el nivel superior de la transición experimenta algún blindaje que no aparece en este modelo.
Para transiciones que terminan en capas superiores, la situación de blindaje se hace mucho más compleja. Del modelo de Bohr, se puede escribir una ecuación para unos rayos X L-alfa, como
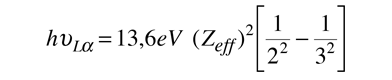
Moseley encontró que sus datos para los rayos X L-alfa, se ajustaba a la relación empírica
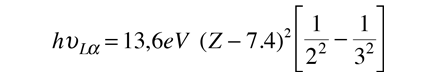
de modo que el mejor ajuste a los datos fue con Z-7,4, indicando un blindaje correspondiente a 7,4 electrones sobre la media dentro de la capa M, donde se originó el electrón.
|