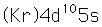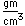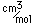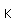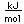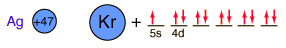Plata
La plata es un metal blando blanco que es más denso que el cobre y tiene un punto de fusión más bajo. Se utiliza en la acuñación de monedas, vajillas y joyas. En una amalgama con mercurio, se utiliza para los empastes de los dientes. En fotografía se utiliza una gran cantidad de plata.
Las monedas de plata en los Estados Unidos han tenido típicamente un 90% de plata y un 10% de cobre. La libra esterlina británica tiene un 92,5% de plata y un 7,5% de cobre.
El compuesto de nitrato de plata (AgNO3) se utiliza para cauterizar llagas y heridas. Se convierte fácilmente en plata metálica por el contacto con la materia orgánica, tal como la piel o la tela, y se utiliza en la fabricación de tinta indeleble.
El ion de plata es un excelente antiséptico, por lo que en medicina se utilizan varios compuestos de plata como agentes germicidas.
Los granos finos de bromuro de plata en suspensión en una delgada capa de gelatina, forman una emulsión fotográfica. La emulsión se forma sobre una lámina de acetato de celulosa. El bromuro de plata es sensible a la luz, y se somete a la descomposición fotoquímica. La gelatina aumenta la sensibilidad a la luz, tal vez por su contenido de azufre. El bromuro de plata descompuesto registra la imagen, y el revelado con una solución alcalina de un agente reductor orgánico como la hidroquinona, hace que los granos sensibilizados sean reducidos a plata metálica, mientras que los granos no expuestos permanecen inalterados.
Los granos no desarrollados del bromuro de plata se eliminan con una solución de fijación que contiene el ion tiosulfato, el cual, forma el complejo de tiosulfato de plata soluble. El negativo puede ser lavado, permaneciendo la imagen de plata.
La plata se encuentra a veces en la naturaleza en forma metálica. Forma parte del mineral sulfuroso Ag2S llamado acantita. Los diversos minerales de plata incluyen a los sulfuros formados con antimonio, llamados estefanita, miargirita y pirargirita. La plata se une con el plomo y el antimonio en el sulfuro andorita, AgPbSb3S6. La plata con cobre y antimonio forma el sulfuro polibasita. La plata con arsénico forma el sulfuro proustita.
En el mineral discrasita, la plata se enlaza directamente al antimonio en la forma Ag3Sb. La plara se enlaza directamente con el telurio en el mineral hessita, Ag2Te. La plata aparece en los minerales cloruros boleita y clorargirita y en el mineral bromuro bromargirita.
La plata es una de las pocas excepciones al orden de llenado general de los orbitales electrónicos como el cobre, que está directamente encima en la tabla periódica. Llena los diez estados 4d antes de llenar el segundo estado 5s. Sólo se muestran esos niveles fuera de un núcleo de kriptón.
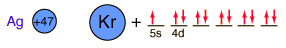
|