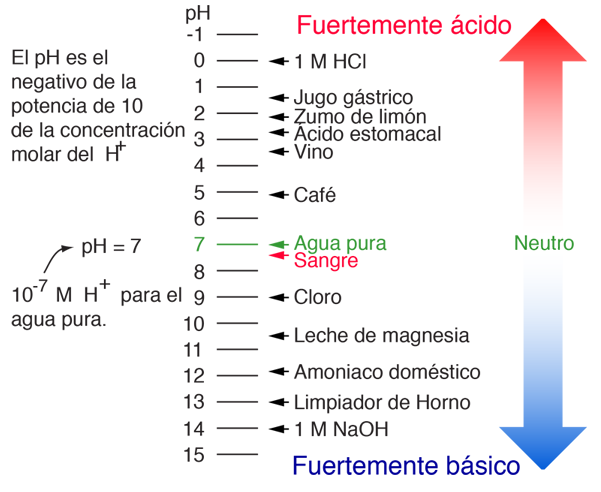
pH
El pH de una solución es una medida de la concentración molar de iones de hidrógeno en la solución y, como tal, es una medida de la acidez o la basicidad de la solución. Las letras pH vienen de "potencia de hidrógeno" y el valor numérico se define como el negativo del logaritmo en base 10 de la concentración molar de los iones de hidrógeno.
pH = -log10[H+]
La medición del pH de una muestra, se puede realizar mediante la medición del potencial de célula de la muestra respecto de un electrodo de hidrógeno estándar, como en el procedimiento aceptado para la medición de potenciales de electrodo estándar. Este procedimiento dará un valor de cero, para una solución 1 molar de iones H+, de modo que eso define el cero de la escala de pH. El potencial de célula para cualquier otro valor de concentración de H+ se puede obtener con el uso de la ecuación de Nernst. Para una solución a 25°C esto da
o
En esta expresión, se hizo un cambio de base de logaritmo natural a logaritmo en base 10 en la ecuación de Nernst.
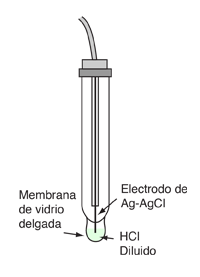
En la práctica, el pH no se mide generalmente de esta manera, ya que requiere de gas hidrógeno a presión estándar, y el electrodo de platino utilizado en el electrodo de hidrógeno estándar falla fácilmente por la presencia de otras sustancias en la solución (Ebbing). Afortunadamente, se pueden calibrar otras configuraciones prácticas de electrodos, para leer la concentración de iones H+. Los medidores de laboratorio de pH se hacen a menudo con un electrodo de vidrio, que consiste en un alambre de plata recubierto con cloruro de plata sumergido en ácido clorhídrico diluido. La solución de electrodo se separa de la solución a ser medida, por una membrana delgada de vidrio. El potencial que se desarrolla a través de esa membrana de vidrio, se puede demostrar que es proporcional a las concentraciones de iones de hidrógeno sobre las dos superficies. En el instrumento de medición, se hace una célula con el otro electrodo, siendo normalmente un electrodo de cloruro de mercurio-mercurio. El potencial de célula es entonces linealmente proporcional al pH y el medidor puede ser calibrado para leer el pH directamente. |
 |
| Ejemplos de Valores de pH |
| Otras Mediciones de Concentración de Iones |
Conceptos de Ácido
Conceptos de Química
Conceptos de Electroquímica
Referencia
Ebbing
Cap. 19
| HyperPhysics | M Olmo R Nave |